¿Qué es la escala de PH?
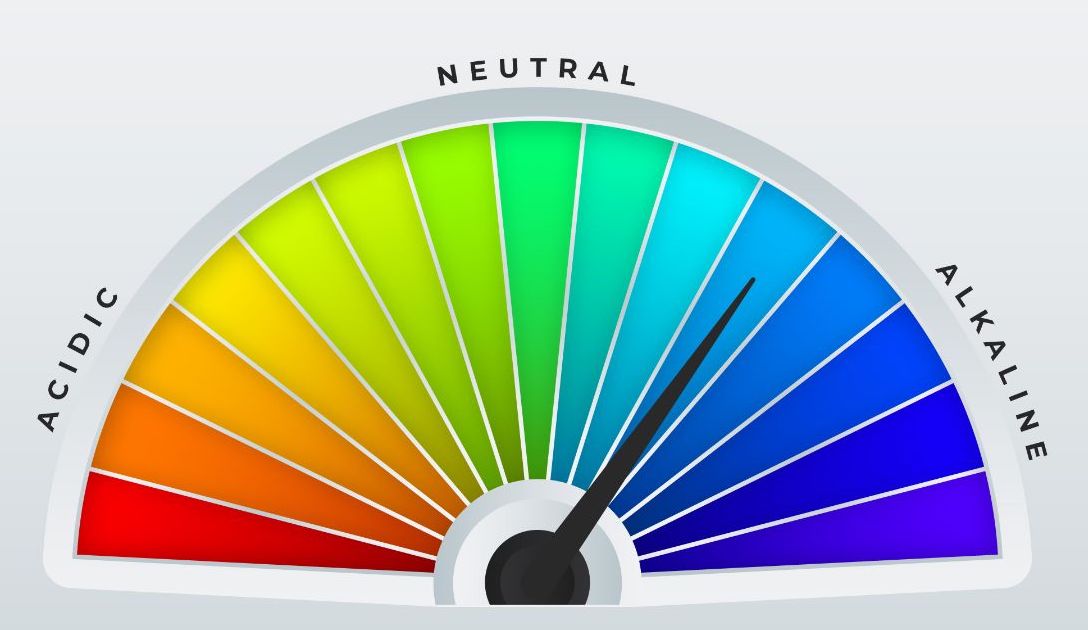
Comencemos por definir al pH como el potencial hidrógeno que es la medida del grado de acidez o
alcalinidad de una sustancia o solución y va de una escala de 0 a 14, donde el pH de 0 es el valor más
ácido, el pH de 14 es el más básico y el pH de 7 es neutro, lo que significa que la sustancia o solución
no es ácida ni alcalina.
Los valores de pH también se utilizan para monitorear la acidez del agua. El agua de lagos, lagunas y
ríos sanos generalmente tiene un pH de entre 6 y 8. La mayoría de los peces tolera agua con pH de entre
6 y 9. Los animales más robustos por lo general mueren en pH más bajos o más altos. Y el pH también se
aplica en la alimentación: el pH del ácido gástrico es de entre 1,5 y 3,5, que es útil para descomponer
los alimentos.
Pero, ¿Quién desarrollo la escala?
En 1909, el químico danés Søren Peter Lauritz Sørensen lo definió tal y como lo conocemos. En su
definición, se considera al pH como el opuesto del logaritmo en base 10 (o el logaritmo del inverso) de
la actividad de los iones hidrógeno. Fue mientras que trabajó en el Laboratorio Carlsberg de la
Cervecería Carlsberg, que Sørensen estudió el efecto de la concentración de los iones sobre las
proteínas, y por qué el ion H+ era particularmente importante.
El significado exacto de la p en pH, de acuerdo con la Fundación Carlsberg, significa “poder de
hidrógeno”. Las letras pH son la abreviatura de 'pondus hydrogenii' (traducido como hidrógeno
potencial), lo que significa poder de hidrógeno, ya que la acidez es causada por un predominio de iones
de hidrógeno (H +). Sørensen, con este descubrimiento, ha sido acreditado como el fundador del concepto
de pH moderno. El contexto para la introducción del pH supuso un lento cambio desde las antiguas pruebas
de cambio de color para indicar el grado de acidez o basicidad de los métodos eléctricos. En este
último, se medía la corriente generada en una celda electroquímica por iones que migraban a electrodos
con carga opuesta, usando un galvanómetro altamente sensible y delicado. Hasta que Sørensen desarrolló
la escala de pH no hubo una forma ampliamente aceptada de expresar las concentraciones de iones de
hidrógeno, y es que él sugirió que la potencia podría estar representada por una escala de pH en la que
7 es neutral y 1 y 14 son los extremos de acidez y alcalinidad, respectivamente.
A partir de ese momento, la escala de pH fue rápidamente aceptada por la comunidad de investigadores
bioquímicos en sus estudios sobre la capacidad de los tejidos vivos para amortiguar el exceso de acidez
o alcalinidad. Ese éxito se debió, en gran parte, a la química médica alemana Leonor Michaelis, que
publicó un libro sobre la concentración de iones de hidrógeno en 1914 y, de esta forma, más químicos
finalmente adoptaron la escala de pH de Sørensen. Pero aún más se extendió el uso del pH en 1935, cuando
Arnold Beckman desarrolló y vendió un simple medidor portátil de pH de lectura directa.
Medidores de PH
Los pHmetros o potenciómetros son instrumentos, milivoltímetro con una escala que convierte el valor de
potencial del electrodo en unidades de pH, que miden la diferencia de potencial entre dos electrodos; un
electrodo de referencia (de calomel o cloruro de mercurio, HgCl) y un electrodo de vidrio que es
sensible al ion de hidrógeno (en cuyo extremo o bulbo, generalmente hay una membrana con de vidrio
sumergida en una solución de ácido clorhídrico (HCl) y cloruro de plata (AgCl). La diferencia de
potencial se produce entre el interior del electrodo de vidrio y las concentraciones de H+ y/o H30+ de
la solución donde se sumergen. A través del cable que se dispone en el interior de ambos electrodos, se
trasmite dicha diferencia de potencial para llegar al aparato y por medio de un amplificador, dar la
medida del valor de pH de esa solución con exactitud, sobre la que se está midiendo su acidez o
alcalinidad.
El primer inventor de tal aparato fue el ingeniero químico norteamericano, Arnold Orville Beckman
(1900-2004), cuando en 1934 un antiguo compañero de la Universidad de Illinois, Glen Joseph quien
trabajaba en un laboratorio de Sunkist Growers, le pidió ayuda para que diseñara un instrumento
eléctrico más resistente para la tarea de medir la acidez del zumo de limón, ya que Joseph intentaba
medir electroquímicamente la concentración de iones de hidrógeno en el jugo de limón, pero los
electrodos de hidrógeno dañados por el dióxido de azufre y los electrodos de vidrio no reactivos
producían señales débiles y eran frágiles.
Beckman, familiarizado con el vidrio soplado, la electricidad y la química, sugirió un diseño que
amplificara los resultados obtenidos con los electrodos de Glen Joseph y terminó construyendo, el
acidímetro, precursor del legendario primer medidor de pH electrónico de éxito comercial. Tras la gran
acogida que tuvo el diseño de Beckman, este vio la oportunidad de patentar la idea y crear acidímetros o
pHmetros portátiles a un precio de 195-205$ cada uno, que serían vendidos a los investigadores de las
diferentes universidades del país. A pesar de encontrarse en plena recuperación de la gran crisis
económica del 29, la empresa iniciada por Arnold Beckman en 1935, Laboratorios Técnicos Nacionales
(NTL), consiguió un éxito considerable al vender en sus dos primeros años de andadura casi medio millar
de estos pHmetros originales. Este pHmetro consistía en un electrodo de vidrio situado en una caja móvil
en la parte delantera del aparato, lo que permitía colocarlo en la muestra analizada; moviendo el
conmutador central calibrado en una escala de pH (pH dial) hasta que se observaba un valor cero en el
galvanómetro situado en la parte superior derecha, se modificaba el valor de la corriente producida por
el circuito eléctrico del pH-metro, la cual era anulada por la producida por el electrodo con la
muestra, por lo que, cuando el galvanómetro marcaba cero, se consideraba que ambas corrientes eran
idénticas y, de este modo, se podía estimar el pH de la muestra. Para que la operación fuera correcta,
era necesario que la escala del conmutador central hubiera sido previamente calibrada, lo que se
realizaba mediante el ajuste de cero. El principal destino de estos instrumentos eran los laboratorios
de investigación, afirmando que ofrecían una gran variedad de usos, con gran precisión en la medida del
pH y de los potenciales de oxidación- reducción de las soluciones problema.
Si requieres ayuda para cotizar algún proyecto o servicio, ¡no dudes en
compartir tus datos con nosotros! Estaremos encantados de resolver todas tus dudas y proporcionarte
la información necesaria.